研究者名:荒木 令江
プロジェクト概要
ヒトゲノム配列の決定により、様々なヒト疾患の原因遺伝子群が解明され、これらに対する合理的な治療法や予防法の開発が可能となることが期待されている。しかしそのためには、その疾患の原因遺伝子だけではなくて、その遺伝子が作る蛋白質と、それに関連して細胞内で時間と共に変動している蛋白質群が織りなす、細胞内クロストークや機能発現制御ネットワークを、翻訳後修飾情報を含めて詳細に解析し、系統的に整理するという「プロテオミクス」が必要不可欠である。このような疾患関連蛋白質群のおりなす細胞内シグナルの詳細な情報は、プロテオーム解析でのみ得ることができ、疾患発症のメカニズム解明・予防・治療薬開発において極めて重要である。
本研究では、特に神経系腫瘍形成に関与する腫瘍抑制遺伝子群に注目し、これらをゲートキーパー遺伝子モデルとして、これに関連して動態を変化させる一連の蛋白質の検出・同定と、これらの相互機能制御機構の解析を、2つのプロテオミクス解析法(differential proteomic display法とmicro affinity chromatography法)にて検討している。本研究室では既に、組織や細胞画分からの微量蛋白質の単離・同定 (二次元電気泳動・画像解析, HPLC, 微量N-, C-末端, 内部アミノ酸シークエンス, マススペクトル, EST data baseによるcDNAクローニング)法を確立し、脳組織細胞プロテオームマップをマウス脳(大脳皮質、小脳、海馬、線条体、臭球、脊髄)及び、ヒト大脳にて作成に応用している。又脳神経系腫瘍抑制遺伝子産物の動態解析、及び細胞内関連分子の同定に応用し、これらの新たな細胞内シグナル伝達機構の数々を明かにしている。このようなプロテオームの情報は、今後のがんの研究のみならずポストゲノム時代の疾患研究に必要不可欠であると考えられ、より高度な解析法、データベース作成を含めての開発を行っている。得られる情報は、ゲノム解析の情報と併せて、合理的な治療法や臨床マーカーや予防法の開発に役立てるための貴重な基礎的情報源となる可能性が高く、臨床医学的にも期待されている。
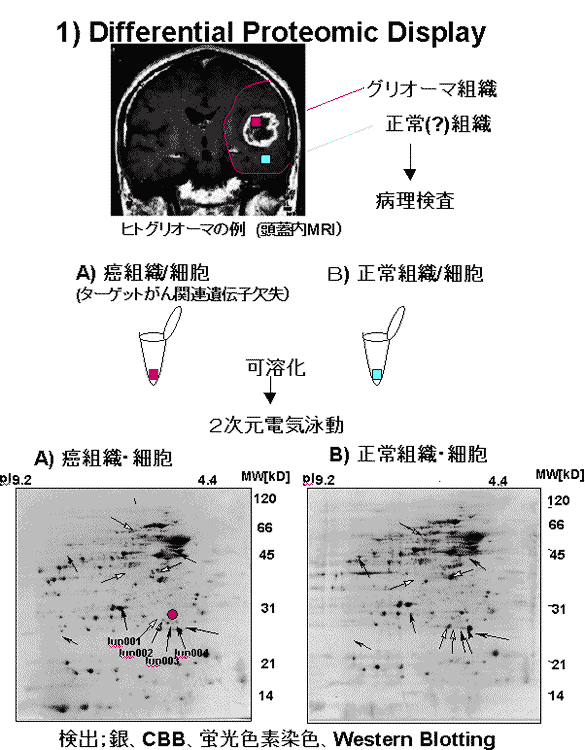
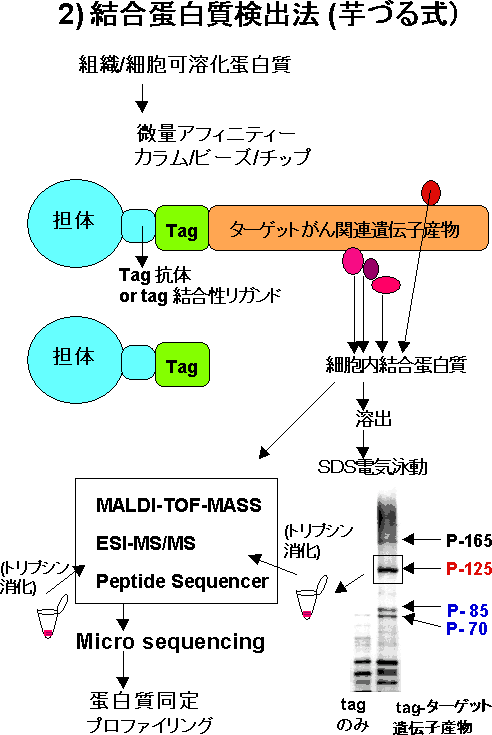
Kimura, Y. Koga, H. Araki, N. Mugita, N. Fujita, N. Takeshima, H. Nishi, T. Yamashima, T. Saido, T. C. Yamasaki, T. Moritake, K. Saya, H. Nakao, M.
The involvement of calpain-dependent proteolysis of the tumor suppressor NF2 (merlin) in schwannomas and meningiomas.
Nature Medicine, 4(8);915-922, 1998
Kuwahara H, Araki N, Makino K, Masuko N, Honda S, Kaibuchi K, Fukunaga K, Miyamoto E, Ogawa M, Saya H.
A novel NE-dlg/SAP102-associated protein, p51-nedasin, related to the aminohydrolyse superfamily, interferes with the association between NE-dlg/SAP102 and NMDA receptor.
J. Biol. Chem. 1999 ;274(45):32204-14
Ito K, Okamoto I, Araki N, Kawano Y, Nakao M, Fujiyama S, Tomita K, Momori T, Saya H.
Calcium influx triggers the sequential proteolysis of extracellular and cytoplasmic domains of E-cadherin, Leading to loss of b-catenin from cell-cell contacts.
Oncogene. 1999, 18(50):7080-90.
Araki, N. , Morimasa T. , Sakai T., Kamo M. , Tokuoh H. , Yunoue S., Miyazaki K., Abe K., Saya H., Tsugita A.
Comparative analysis of brain proteins from p53 deficient mice by two-dimensional electrophoresis.
Electrophoresis.21, (9) 1880-1889, 2000
荒木令江;
「癌とプロテオーム」、遺伝子医学、14号、Vol.4, (4), 605-611, 2000年、
Tokuo, H., Yunoue, S., Feng, L., Kimoto, M., Tsuji, H., Ono, T., Saya, H., Araki, N.
Phosphorylation of neurofibromin by cAMP dependent protein kinase is regulated via a cellular association of NG, NG-dimethylarginine dimethylaminohydrolase.
FEBS Letters, 2001 494:48-53.
Araki, N., Tokuo, H., Yunoue, S., Feng, L., Ozawa, T., Tsugita, A., Saya, H
Proteomic analysis of tumor suppressor reltated proteins in central nervous system.
J. Chromatogr. B, in press.
荒木令江;脳疾患の発現プロテオミクス解析、実験医学、20(1)、2002 印刷中
研究者名:荒木 令江
プロジェクト概要
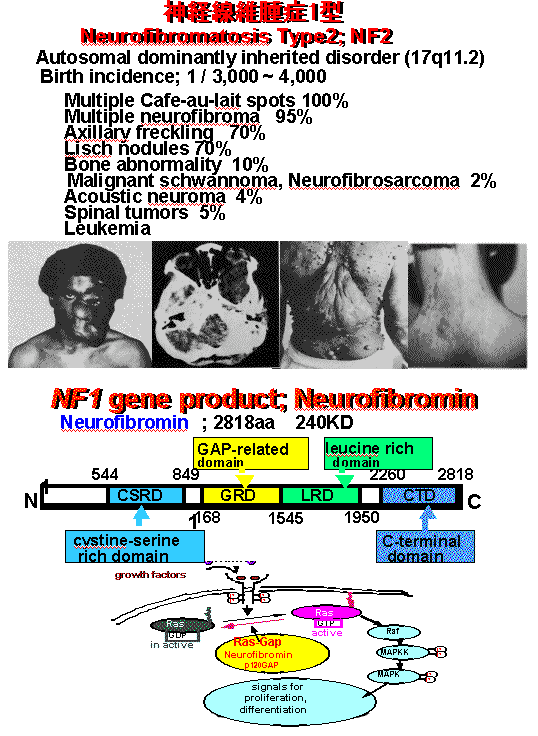
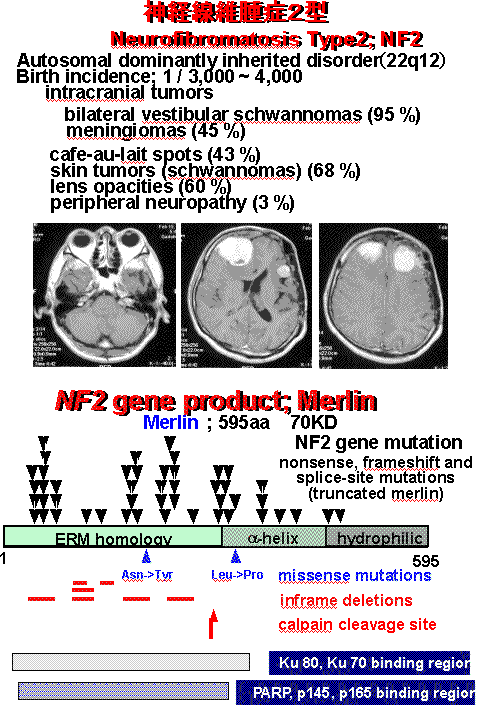
神経線維腫(neurofibromatosis:NF)は、"エレファントマン病"として知られる、全身の皮膚に多発性結節と色素斑、神経系悪性腫瘍、知能障害等の多彩な病態を伴う優性遺伝性疾患として最初に報告された1型(NF1)、及び1型と類似した皮膚症状に加え中枢神経系腫瘍を高頻度に伴うことで特徴づけられる2型(NF2)の2つのタイプに分けられる。近年、これらの神経線維腫症の原因遺伝子がそれぞれ異なった染色体上に同定され、NF1, NF2が独立した疾患であることが判明した。即ちNF1が17番染色体長腕の異常に連鎖し、皮下の多発性神経線維腫、皮膚色素斑などに加え線維肉腫、グリオーマなどの悪性腫瘍を伴う頻度が高いのに対して、NF2は22番染色体長腕の異常に連鎖し、両側聴神経鞘腫、多発性髄膜腫などの頭蓋内良性腫瘍をほぼ必発することを特徴とする。遺伝子が同定されたことにより本疾患の発症メカニズムが明らかになるものと期待されたが、構造から予想される遺伝子産物の機能と疾患の表現型との間にはなお大きな距離があり、その羅漢率の高さに反して治療法、予防法は今のところない。本研究室では、NF1及びNF2の病態発症予防・治療のための基礎的情報を得ることを目的として、それぞれの原因遺伝子産物;NF1蛋白(ニューロファイブロミン)及びNF2蛋白(マーリン)の細胞内機能を詳細に解析している。
本研究室では現在までに以下の所見を見いだしている。1)NF1遺伝子のGTPase activating protein (GAP)相同領域に、可変スプライシングがあることを見いだし、神経系細胞の分化に伴いスプライシングパターンが変化することを発見した2)NF1蛋白がcAMP依存性キナーゼによってリン酸化されることを見いだした。3)NF2蛋白に5つの細胞内蛋白が結合することを見いだし、変異によって結合が障害されることを見いだした。4)NF2患者のNF2遺伝子の変異パターンをPTT assayにより測定し、NF2蛋白質の変異による細胞内局在・形態・結合蛋白質との相互作用変化を同定した。5)NF2蛋白が細胞内でカルパインによって分解されることを同定し、細胞内の蛋白分解系の活性亢進によってNF2蛋白の分解が異常に生じることが、腫瘍化の一要因である可能性について報告した。本研究は、NFに関連する腫瘍は、NF1, NF2遺伝子産物を介したシグナルによる細胞増殖抑制と、脱落するべき細胞の生理的アポトーシスの誘導の破綻によって生成するという我々の仮説に基づき、細胞内でこれらと相互作用してシグナルを伝達する分子の解析や、それぞれの遺伝子をターゲッティングした細胞と正常細胞の比較検討を生化学・細胞生物学的な手法を用いてることによって、詳細な腫瘍抑制メカニズムを解析していることを特徴としており、日本のみならず、世界においても先行した研究である。
Araki N, Takeshima H, Saya H
Neurofibromatosis type 2.
Gan To Kagaku Ryoho 24(11), 1427-1431 (1997)
Koga, H. Araki, N. Hirota, T. Kumura, Y. Nakao, M. Saya, H.
Impairment of cell adhesion by expression of the mutant neurofibromatosis type 2(NF2) gene products missing exon in ERM-homology domain.
Oncogene17; 801-810, 1998
Kimura, Y. Koga, H. Araki, N. Mugita, N. Fujita, N. Takeshima, H. Nishi, T. Yamashima, T. Saido, T. C. Yamasaki, T. Moritake, K. Saya, H. Nakao, M.
The involvement of calpain-dependent proteolysis of the tumor suppressor NF2 (merlin) in schwannomas and meningiomas.
Nature Medicine, 4(8);915-922, 1998
Araki, N., Saya, H.
Cellular signal transduction via the neurofibromatosis type 2 tumor supressor gene product; Merlin.(神経線維腫症2型(NF2)遺伝子産物Merlinの細胞内シグナル伝達とその腫瘍抑制機構について)
Seikagaku, Vol. 71(2), 43-49, 1999
Araki, N., Tokuo, H., Yunoue, S., Kuwahara, H., Morimasa T., Tsugita, A., Saya H.
Functional proteomic analysis of tumor suppressor related proteins in brain.
New Movement of Science "Proteomics" BIOJAPAN 2000. pp147-157, 2000.
Japan Bioindustry Association (JBA), Japan Health Sciences Fundation (JHSF), Society for Techno-innovation of Agriculture, Forestry and Fisheries (STAFF), Japan Association of Bioindustries Executives (JABEX)
研究者名:荒木 令江
プロジェクト概要
生体内において、ほとんどの蛋白質が翻訳後修飾を受けている。特に老化や、高血糖に伴い多くの生体タンパク質が、アミノ末端のα-アミノ基、あるいはリジンのε-アミノ基を介して非酵素的に糖付加反応(メイラード反応)を受けており、(シッフ塩基・アマドリ転位反応生成物を経て)、多段階の脱水、縮合、酸化反応の後、蛋白分子上に特有な化学構造体(AGE)を発現している。荒木らは、この後期生成物(AGE; Advanced glycation end products)に対する特異抗体(6D12)を世界に先駆けて開発し、AGE共通構造体が生体内に確かに存在し、加齢によって増加していること、糖尿病合併症や老化現象に特徴的な病変部に特にAGEが蓄積していることをはじめて証明した。更に、AGEタンパク質を特異的に強く認識する細胞膜レセプターがマクロファージ系細胞に存在することを見い出し、AGEがレセプターを介して、種々のサイトカインや増殖因子を誘導し、細胞の増殖や遊走を励起することを明らかにした。又、糖尿病のヒト血液中からAGEに対する自己抗体を検出し(特願平11-111314)、それに対するいくつかの新規のエピトープとなる化学構造体を同定した(特願2000-54245)。これらの事実に基づき、AGEのような生体蛋白質の化学修飾による構造変化が、老化現象や糖尿病合併症や癌等の病態と密接に関係することに注目し,これらの修飾を受ける蛋白質とその構造変化の解析法開発、及び生物学的意義に関する基礎的研究を行っている。
関連論文
Araki, N. and Horiuchi, S.
Advanced glycation end products of the Maillard reaction: structures and biological significance. in "The Post-translational Modification of Proteins" (Eds. by Tsuboi S., Katsunuma, N., and Taniguchi, N.)
Japan Science Society Press, Tokyo/Springer-Verlag, Berlin. pp 253-272,1992
Araki, N., Ueno, N., Chakrabarti, B, Morino, Y. and Horiuchi, S.
Immunochemical evidence for the presence of advanced glycation end products in human lens proteins and its positive correlation with aging.
J. Biol. Chem. 267: 10211-10214.(1992)
Horiuchi, S., Araki, N
Advanced glycation end productsof the Maillard reaction and their relation to aging.
Gerontology, 40, 10-15. (1994)
Araki, N., Higashi, T., Mori, T., Shibayama, R., Kawabe, Y., Kodama, T., Takahashi, K., Shichiri, M., and Horiuchi, S
Macrophage scavenger receptor mediates endocytic uptake of advanced glycation end products of the Maillard reaction.
Eur. J. Biochem. 230, 408-415,1995
Horiuchi,S., Higashi,T., Ikeda, K., Saishoji, T., Jinno-uchi,Y., Sano, H.,Shibayama, R., Sakamoto, T. and Araki, N.
Advanced Glycation End Products (AGE) and their recognition by macrophage and macrophage-derived cells.
Diabetes 45 sup3 s73-75 1996
Shibayama R, Araki N, Nagai R, Horiuchi S,
Autoantibody against N(epsilon)-(carboxymethyl)lysine: an advanced glycation end product of the Maillard reaction.
Diabetes. 1999 48(9):1842-9.
Araki, N., Shibayama, R., Nagai, R., Araki, T., Horiuchi, S.
Study of autoantibody against advanced glycation endproducts of the Maillard reaction.
New Development in Glycomedicine,Ed.by Endo, M. Elsevier Science B.V in press.